За последние несколько дней появились сразу три новости, связанные с липидным метаболизмом.
Начнем с животных, с голого землекопа. Как все знают, голый землекоп — это долгожитель с многочисленными уникальными особенностями. У него меньше окисляются липиды в мембранах и производится меньше КПГ, более устойчивый к повреждениям геном, стабильный с возрастом сплайсинг и менее активные ретротранспозоны. Землекоп также имеет уникальный высокомолекулярный гиалуронан и повышенную чувствительность к контактному ингибированию клеток, что защищает его от перерождения клеток.
Теперь в «копилку» долголетия землекопа японские ученые добавили ещё и уникальный липидный метаболизм. А точнее, метаболизм холестерина. Который защищает клетки землекопа от сенесцентности. И связано это, как определили ученые, с повышенной активностью белка β-катенина (по сравнению с мышами) и накоплением в клетках-фибробластах липидных капель с повышенным содержанием холестерина.
Нокаут β-катенина подавлял аполипопротеин F (апо-F) и путь LXR / RXR, которые участвуют в транспорте и биогенезе холестерина. А снижение активности апо-F в свою очередь подавляло накопление липидных капель и способствовало клеточному старению. Что указывает на то, как пишут ученые, что апо-F опосредует передачу сигналов β-катенина в клетках землекопа.
Вторая новость – уже более практичная.
В Science пару дней назад вышла статья с довольно громким названием: «Перепрограммирование липидного обмена предотвращает старение эффекторных Т-клеток и усиливает иммунотерапию опухоли».
Мы готовим большой материал по иммуноонкологии, и здесь можно прочесть про одно из направление — работу с белком CD47 (и ознакомиться с нашей подборкой лучших биотех компаний, работающих с CD47 как с таргетом потенциальных терапий). Значение иммунитета в борьбе с онкологией, наверное, никому объяснять не надо — оно очень большое. И любой успех в иммуноонкологии будет очень кстати в борьбе со старением. Что же показала новая работа?
Для начала скажем, что функциональное состояние Т-клеток выступает ключевым фактором эффективного противоопухолевого иммунитета и иммунотерапии. Это основа. Клеточный метаболизм, включая метаболизм липидов, контролирует дифференцировку, выживание и эффекторные функции Т-клеток.
Ученые описали, что развитие сенесцентности Т-клеток вызывается как злокачественными опухолевыми клетками, так и регуляторными Т-клетками. И является общей чертой онкопатологий.
При этом старые Т-клетки обладают активным метаболизмом глюкозы и нарушенным метаболизмом липидов. Этот несбалансированный метаболизм липидов приводит, в свою очередь, к изменениям экспрессии ферментов метаболизма липидов. Что в итоге изменяет виды липидов и накопление липидных капель в Т-клетках.
Опухолевые клетки и регуляторные Т-клетки повышают экспрессию фосфолипазы A2. Которая гидролизует мембранные фосфолипиды и ответствененна за измененный метаболизм липидов и индукцию клеточного старения, наблюдаемую в Т-клетках. Исследователи ингибировали фосфолипазу A2, что улучшало метаболизм липидов Т-клеток и предотвращало их старение. А также повышало противоопухолевый иммунитет и эффективность иммунотерапии на животных моделях.
Вместе эти результаты, как пишут авторы, определяют механистические связи между старением Т-клеток и регуляцией липидного метаболизма в микроокружении опухоли и обеспечивают новую мишень для иммунотерапии опухолей.
И третья работа, тоже с немало говорящим названием, «Открытие нелипогенных соединений, индуцирующих ABCA1, с потенциалом при болезни Альцгеймера и диабете 2 типа».
Как мы видим из названия, ученые объединяют эти две патологии, Альцгеймер и диабет. По имеющимся данным, у них много общих причин. Таких, как воспаление, окислительный стресс, дисфункция митохондрий, накопление КПГ и др. Логично, что ученые поставили себе целью разработать способ выявления соединений, которые противодействовали бы развитию как Альцгеймера, так и диабета 2 типа.
И что же они обнаружили? Известно, что уровень холестерина повышается из-за резистентности к инсулину. В ответ на что организм запускает «обратный транспорт холестерина», во время которого специальные молекулы переносят избыток холестерина в печень для его вывода из обращения.
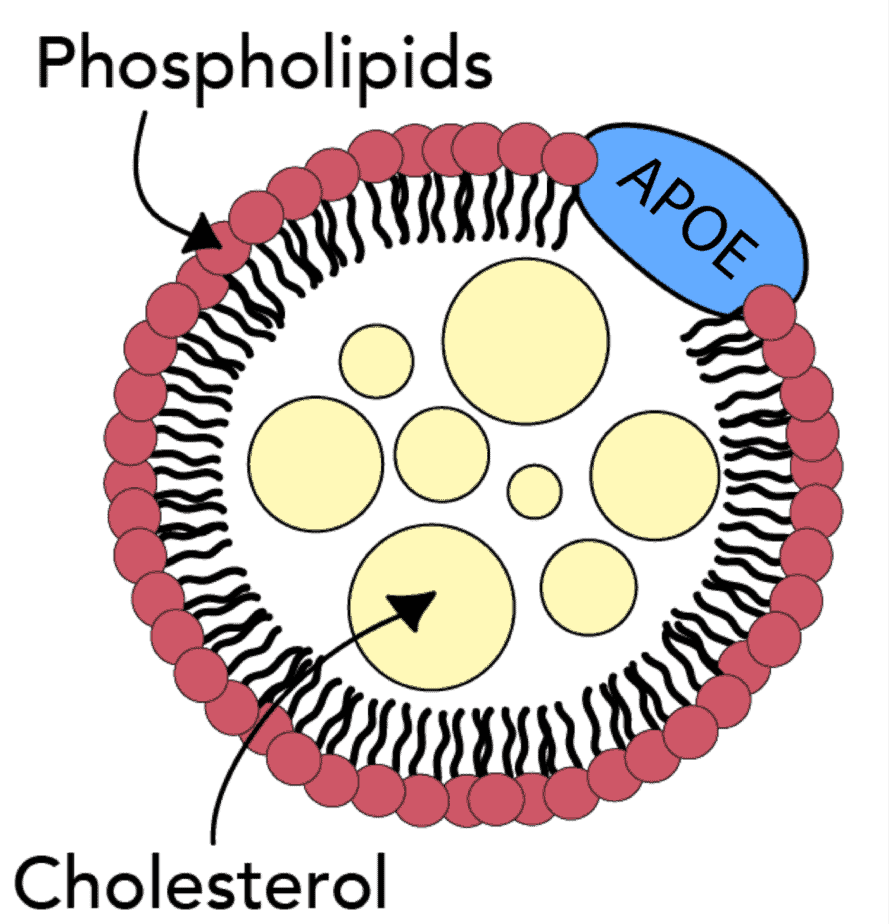
Известный в геронтологии белок, Аполипопротеин E (APOE) – как раз один из белков, участвующих в обратном транспорте холестерина. Генетически варианты APOE выступают самым сильным фактором риска болезни Альцгеймера. А также независимым фактором риска диабета 2 типа и сердечно-сосудистых заболеваний.
Снижение активности ещё одного переносчика холестерина, ABCA1, также коррелирует с повышенным риском сердечно-сосудистых заболеваний, диабета 2 типа и болезни Альцгеймера. Благоприятные эффекты повышения активности ABCA1 включают контроль оттока холестерина и фосфолипидов к аполипопротеинам с низким содержанием липидов, с формированием полезных ЛПВП в головном мозге и ослаблением воспаления.
В этом исследовании авторы разработали способ выявления небольших молекул, которые улучшают функцию ABCA1 в организме, избегая при этом нежелательного воздействия на печень. Ученые идентифицировали небольшую молекулу, CL2-57, способную стимулировать активность ABCA1, положительно влияя на триглицериды печени и плазмы. Использование этого соединения на животной модели показало улучшение толерантности к глюкозе и чувствительности к инсулину, а также снижение массы тела.