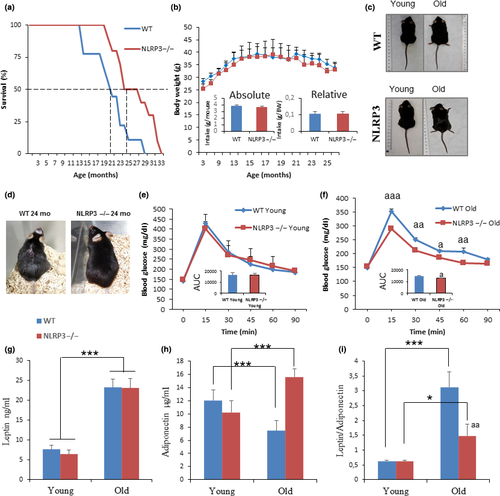
Все исследование можно рассказать в двух предложениях: ученые создали мышиную линию, в которой нокаутирован ген NLRP3. В результате этого мыши жили примерно на 30% дольше, чем контрольные, и оставались более здоровыми. Вот посмотрите на график выживаемости. WT, голубая линия — wild type, мыши дикого типа, NLRP3 –/–, красная линия — мыши с нокаутированным геном NLRP3. Правда мы точно не поняли, но всего было около 60 мышей, но это не точно. Написали авторам, чтобы узнать наверняка.
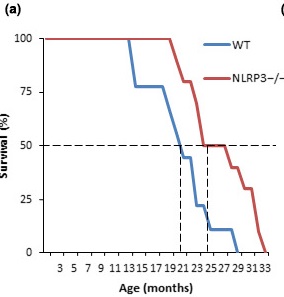
И тут мы должны немного подумать. Ученые наконец-то нашли лишний ген, и если этот ген вырубить, можно продлить жизнь мышам на сколько-то процентов? Может, мне тоже вырубить себе этот ген?
Внутренний скептик подсказывает, что рано радоваться. И действительно: мыши жили в условиях, называемых “specific pathogen‐free conditions” — то есть условиях, свободных от каких-то выбранных патогенов. То есть таких патогенов, которые испортят ученым эксперимент.
Дело в том, продукт гена NLRP3 — белок криопирин, важный для врожденного иммунного ответа. Криопирин — цитозольный белок, Nod-подобный рецептор семейства NALP, основной компонент одноимённого типа инфламмасом.
Инфламмасома — это такой многобелковый комплекс, отвечающий за активацию воспалительного ответа. Способствует секреции провоспалительных цитокинов: IL-1β и IL-18. А их секреция, в свою очередь, вызывает пироптоз — это такой вид программируемой клеточной гибели, при котором мембрана клетки разрывается и все ее содержимое выливается наружу.
Вот пироптоз-то и есть тот самый важный процесс врожденного иммунитета, о котором мы говорили. Пироптоз ограничивает размножение внутриклеточных патогенов.
Теперь надо объяснить, как ген NLRP3 связан с сердечно-сосудистыми заболеваниями. А вот так: уровень связанных с ним инфламмасом повышается после инфаркта миокарда, при атеросклерозе, ишемической болезни сердца, диабетической кардиомиопатии, хронической сердечной недостаточности и гипертонии (Bullón et al., 2017; Liu, Zeng, Li, Mehta, & Wang, 2017). Ну и вообще, маркеры воспаления связаны с сердечно-сосудистыми заболеваниями.
Ранее уже было показано, что генетическая делеция (потеря участка хромосомы с геном) NLRP3 у мышей улучшает их состояние здоровья путем ослабления множественных возрастных дегенеративных изменений (Youm, 2013). Более того, NLRP3 у старых мышей увеличивала мышечную силу и выносливость и предотвращала возрастное увеличение количества миопатических волокон (McBride et al., 2017).
А вот роль воспаления NLRP3 в продолжительности жизни и старении сердца была не изучена. И в работе, о которой мы тут говорим, ученые поставили задачу определить, может ли нокаут гена NLRP3 влиять на продолжительность жизни и потенциально предотвращать старение сердца.
Для этого они провернули эксперимент, в котором измерили мышам много разных маркеров. Честно говоря, список этих маркеров вызвал у меня чувство глубокого удовлетворения, потому что я бы и сам все это измерил.
Вот эти маркеры:
- толерантность к глюкозе натощак (мыши голодали ночью 16 часов, а потом им вкалывали в брюшную полость глюкозу из расчета 1 г/кг);
- лептин, адипонектин, IGF‐1 в сыворотке крови;
- сывороточные биомаркеры: глюкоза, триглицериды, холестерин, мочевая кислота, аспартатаминотрансфераза, аланинаминотрансфераза и креатинкиназа;
- электрокардиография.
И вот что у них получилось:
- У мышей NLRP3 –/– (с отключенным геном NLRP3) по сравнению с контрольной группой животных была увеличена средняя продолжительности жизни на 34% и максимальная продолжительности жизни на 29%.
- Контрольные мыши к 24 месяцам оказались более лысые, чем экспериментальные.
- Экспериментальные были более толерантны к глюкозе.
- Уровни глюкозы в крови и циркулирующего IGF‐1 были снижены у молодых и старых NLRP3 –/– мышей, что указывает на то, что их чувствительность к инсулину была выше, чем у контрольных.
- Лептин у молодых и старых NLRP3 –/– был примерно на том же уровне, что и у контрольных, но вот отношение лептина к адипонектину с повышенным уровнем адипонектина было ниже у старых NLRP3 –/– мышей. Лептин — это регулятор веса, не изменился, и ладно. Масса контрольных и экспериментальных мышей и количество потребляемой ими пищи тоже не различались. Но вот дисбаланс отношения лептина к адипонектину ассоциирован с ССЗ, метаболическим синдромом и неалкогольной жировой болезнью печени.
- Уровень липидов в плазме крови был ниже у NLRP3 –/– старых мышей.
- Уровни активной каспазы 1 и IL-1β были выше у старых контрольных мышей по сравнению с мышами NLRP3 –/– .
- Повышенные уровни TNF‐α, IL-6 и IL-8 наблюдались примерно одинаково и у контрольных, и у NLRP3 –/– мышей. Это показывает, что потеря NLRP3 не влияла на возрастное увеличение других воспалительных путей.
- Масса сердца была выше у диких мышей контрольной группы по сравнению с мышами NLRP3 –/–. Гипертрофия сердца, измеренная по толщине стенки левого желудочка, была значительно увеличена у старых диких мышей по сравнению с мышами NLRP3 –/–.
Электронный микроскопический анализ показал, что количество накопленных аутофагосом было уменьшено в сердцах у старых мышей NLRP3 –/–. Это объясняется тем, что ингибирование NLRP3 вызывало улучшение качества аутофагии в сердце при старении. Полученные данные показывают, что нокаут гена NLRP3 предотвращал многие возрастные изменения в сердце, сохранял функцию сердца у старых мышей, увеличивая продолжительность жизни.
Тут еще одна важная деталь. В разделе Discussions авторы говорят, что увеличение толерантности к глюкозе, снижение соотношения лептина и адипонектина, а также регуляция дислипемии связаны с общими путями, такими как IGF-1, PI3K/AKT/mTOR, также замешаны аутофагия и внутриклеточные уровни NAD+. У старых NLRP3 –/– мышей был низкий сывороточный уровень IGF-1. Роль IGF-1 противоречива, но авторы работы пишут, что низкие уровни IGF-1 в сыворотке являются конечным продуктом снижения передачи сигналов инсулин / IGF-1, что, как известно, продлевает жизнь как у беспозвоночных, так и у позвоночных (Finkel, 2015).
Чему же нас учит эта работа? Какой из нее можно сделать вывод?
Авторы померили много чего, поэтому и выводы могут быть разными.
Например: в развитии ССЗ большую роль играет воспаление, но не абы какое, а такое, в котором замешан пироптоз. Ведь TNF‐α, IL-6 и IL-8 не различались у контрольных и экспериментальных мышей.
Или такой: все упирается в инсулин и IGF-1.
Или такой: в любой непонятной ситуации измеряй как можно больше маркеров, даже если тебе кажется, что пироптоз, толерантность к глюкозе, и соотношение лептин/адипонектин не имеют ничего общего. Прям бери панель биомаркеров и как можно больше измеряй, результат будет интересным.
Или такой: с генами вечно так — один отрубишь, вся система поедет. И чтобы разобраться, куда она поедет, надо обязательно составлять карты генов, наполнять базы данных и изучать, как эти гены соотносятся. Нет, ну правда: кто бы мог подумать, что пироптоз, то есть способность клетки разорваться и разлить свое содержимое по близлежащему межклеточному матриксу, как-то связан со старением, да еще и через глюкозу?
Тут давайте поподробнее. Гены не работают поодиночке. Они там все повязаны друг на друга, один регулирует другой, эффект бабочки. И самая засада в том, что мы очень плохо видим, что на что влияет. Мы тыкаемся как слепые котята, в надежде найти нужные терапевтические мишени. Нам нужна карта, руководствуясь которой, мы могли бы легко найти путь из пункта А в пункт Б. Б — это бессмертие))
Именно поэтому мы начали делать нашу базу всех вот таких генов связанных с увеличением продолжительности жизни. Расскажем о ней позже, возможно в декабре.
Наша задача — установить множество взаимосвязей, играющих решающую роль в возможном увеличении продолжительности жизни человека. Плюс, конкретно эта статья вызвала большую дискуссию в сообществе Open Longevity, возможно ли воспроизвести её результаты. Поэтому также хорошо иметь на руках базу касательно генов старения и долголетия, оценивающую достоверность научных результатов.
Вот вам полный текст статьи, которую мы здесь обсуждали, для раздумий.