Компания была основана в 2008 году и сначала называлась Viventia Bio. В 2016-м, в результате поглощения более крупной компанией Eleven Biotherapeutics, была преобразована в Sesen Bio.
К 2016 году у тогдашней Viventia было в разработке 2 основных препарата: Vicineum и Proxinium. Это противоопухолевые гибридные белки, оптимизированные для местного введения в опухоли. Оба целятся против EpCAM — молекулы адгезии эпителиальных клеток, которые в большом количестве экспрессированы на клетках некоторых опухолей (например, рак головы и шеи и некоторые формы опухолей мочевого пузыря).
При этом Vicineum и Proxinium ждала разная судьба. Proxinium принимал участие в двух КИ, но они были досрочно прекращены. Официальная причина — «корпоративные обстоятельства, не связанные с безопасностью и эффективностью препарата». КИ было остановлено примерно за год до слияния Viventia Bio и Eleven Biotherapeutics и, возможно, это связано с выбором Vicineum в качестве основной R&D программы (но это только предположение).
В итоге, после того, как отвалился Proxinium, Vicinium стал лидирующей программой Sesen Bio. Он уже успешно прошел все стадии КИ при раке мочевого пузыря высокой степени злокачественности (high grade NMIBCs) у пациентов после неудачной терапии вакциной БЦЖ.
Рак мочевого пузыря — шестой по частоте диагноз рака в США, и примерно у 80% пациентов диагностируется NMIBC. Для пациентов с опухолями, резистентными к терапии БЦЖ, рекомендуемым вариантом лечения является радикальная цистэктомия (полное удаление мочевого пузыря) или использование анти-PD-1 терапии препаратом Кейтруда. В случае одобрения FDA, Vicineum может стать одним из вариантов лечения NMIBC.
О результатах КИ Vicineum стоит сказать отдельно пару слов. На основе 3-месячных данных частота полного ответа при терапии Vicineum составила 42%, что считается очень хорошим показателем для иммунотерапевтических препаратов. Предварительные опубликованные данные КИ у пациентов с рецидивирующим папиллярным NMIBC демонстрируют безрецидивный ответ в 68% случаев через 3 месяца после начала терапии. Результаты III фазы КИ можно посмотреть тут.
В настоящее время препарат проходит стадию регистрации в Китае, Европе и в США. FDA предоставило препарату статус Priority Review, и на 18 августа 2021 года намечено событие PDUFA, когда препарат может быть одобрен для клинического применения.
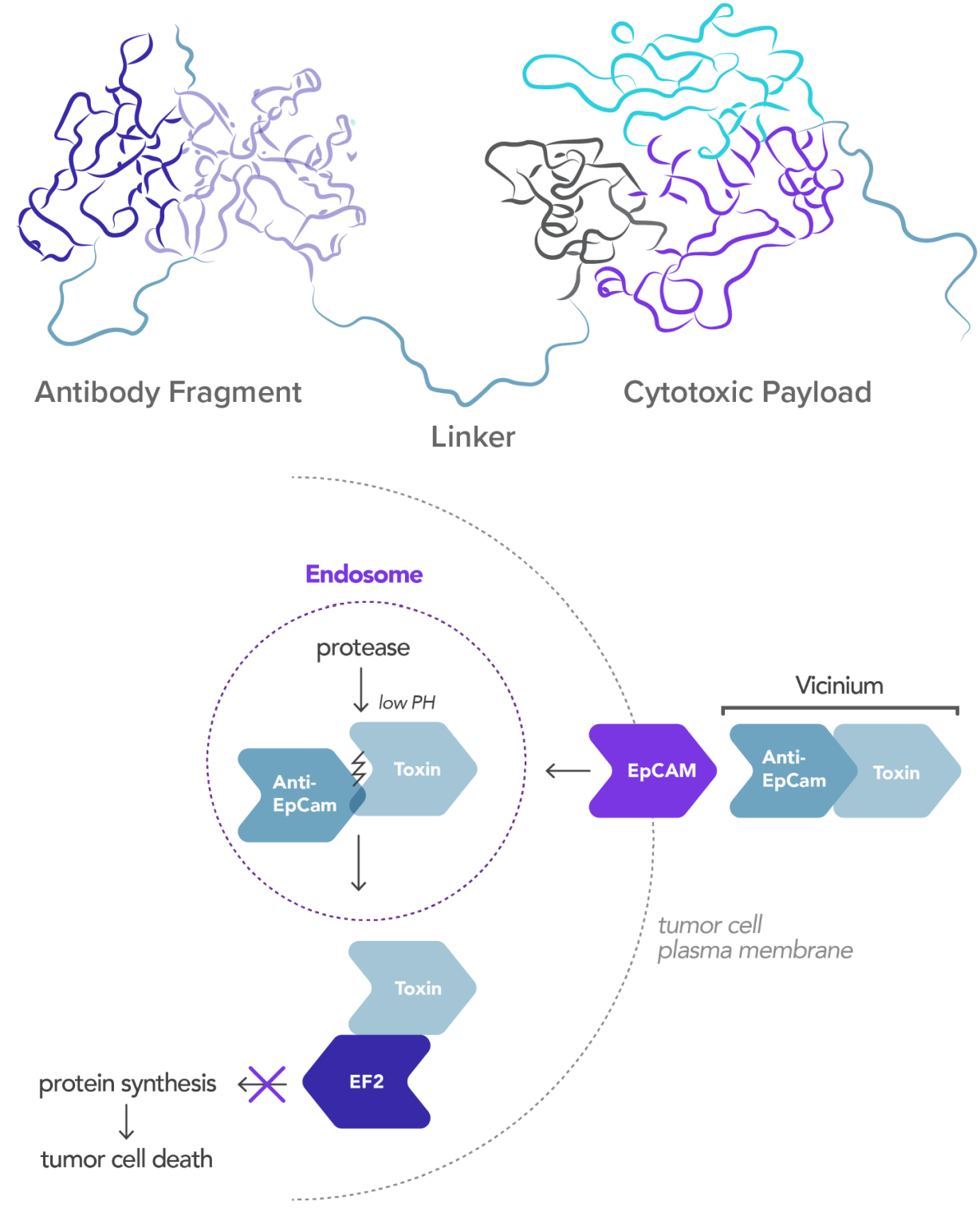
Vicineum — гибридный белок. Состоит из 2х фрагментов: mAb, специфичного к EpCAM, и пептида с цитотоксическим действием, которые соединены между собой пептидным линкером, позволяющим гибридному белку сохранять интактное состояние до попадания в клетки опухоли.
Механизм действия препарата следующий: анти-EpCAM фрагмент доставляет токсин прямо в клетки опухоли с высокой экспрессией EpCAM. Протеазы клетки разрушают линкер и высвобождают токсин, который блокирует синтез белка в клетке, убивая как быстро делящиеся так и медленно делящиеся клетки опухоли.
Сильные стороны препарата:
1) EpCAM высокоэкспрессирован в >98% случаев при раке мочевого пузыря высокой степени злокачественности, но его мало на здоровой ткани мочевого пузыря, что позволяет препарату специфически действовать на раковые клетки;
2) кроме того, EpCAM экспрессируется при многих формах рака, и в Sesen Bio считают, что Vicineum имеет высокий потенциал применения для других форм солидных опухолей;
3) в Sesen видят высокий потенциал применения Vicineum с другими иммунотерапевтическими препаратами, прежде всего с ингибиторами иммунных чекпоинтов.
Также интересна и другая R&D программа Sesen Bio, в рамках которой разрабатываются препараты на основе рекомбинантного белка deBouganin.
DeBouganin — это модифицированный вариант природного токсина буганина, который получают из экстракта листьев растения Бугенвиллея (Bougainvillea spectabilis Willd.), обладающего противовирусными свойствами.
Буганин — это рибосом-инактивирующий белок I типа (RIP I), который оказывает свое токсическое действие за счет деаденилирования рибосомной РНК, блокировки синтеза белка и индукции запрограммированной гибели клеток [раз, два, три].
Используя deBouganin, в Sesen Bio получают и тестируют различные гибридные белки. Например, anti-PSMA Humabody-deBouganin состоит из гуманизированного антитела к простат-специфическому белку или anti-EpCAM Humabody-deBouganin — он создан на основе EpCAM.
DeBouganin, как компонент гибридных белков, можно комбинировать с любыми молекулами для обеспечения специфического действия на опухоли, кроме того он обладает низкой иммуногенностью, подходит для системного введения в организм и имеет высокий профиль безопасности.
В случае одобрения в августе 2021 препарата Vicineum, в Sesen Bio ожидают получение общей выручки от реализации своей продукции в мире в размере $1–3B, только в США — $400–900M.
NASDAQ: SESN

